

조장환 교수
서울대학교 화학생물공학부
조장환 교수
서울대학교 화학생물공학부
합성생물학 기반 바이오의약 소재 생산 기술
최근 합성생물학의 발전으로 과거에는 치료가 어렵거나 불가능했던 질병에 대해 새로운 치료법이 개발되고 있습니다. Adeno-associatedvirus(AAV)를 이용한 유전성 망막 질환 치료제, gamma retrovirus를 이용한 중증복합면역결핍증(SCID, Severe combined immunodeficiency) 치료제, 그리고 chimeric antigen receptor T 세포를 사용한 혈액암 치료제 등 다양한 유전자 및 세포 치료제가 등장했을 뿐만 아니라 유전자 가위(CRISPR-Cas9) 및 Base editor 등 다양한 차세대 유전자 치료제 또한 임상실험 중에 있습니다. 이러한 이유로 Precedence research에서는 합성생물학 기반 치료제 매출이 2021년 18억 달러에서 2024년 1,120억 달러로 성장할 것으로 예측하고 있습니다. (그림 1).
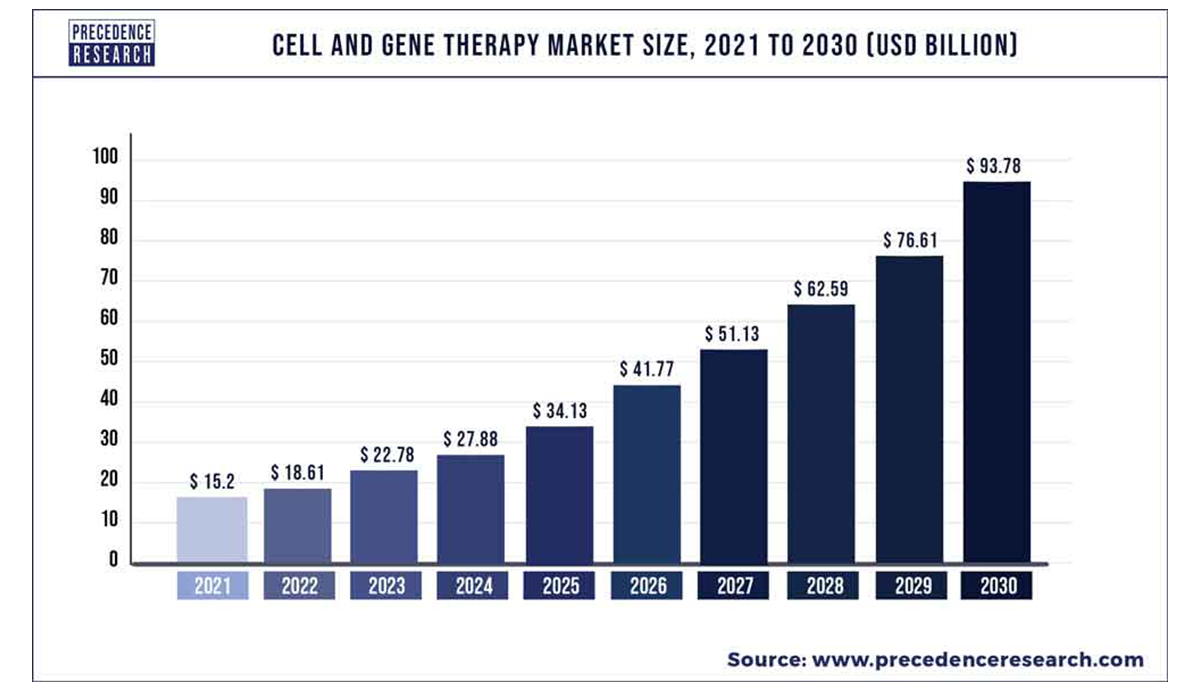
이 글에서는 합성생물학을 기반으로 한 유전자 치료제와 CAR-T 세포 치료제에 대해 살펴보고자 합니다.
1. 유전자 치료제
우리 몸 안의 DNA에는 올바른 단백질을 만드는 정보가 포함되어 있습니다. 이러한 DNA에 변이가 일어나면 올바른 단백질의 생산 또는 기능에 영향을 미쳐 질병을 유발할 수 있습니다. 변경된 유전자로 인해 필요한 단백질에 결함이 있거나 누락된 경우 유전자 치료를 통해 새로운 유전 물질을 세포에 도입함으로써 올바른 단백질 발현을 유도하여 단백질의 기능을 복구하고 질병을 치료할 수 있습니다.
일반적으로 인간 세포에 직접 유전 물질을 전달하기가 쉽지 않기 때문에 연구자들은 바이러스가 인간 세포를 잘 감염 시킨다는 사실에 착안하여, 특정 바이러스를 유전 물질을 전달하는 운반체(흔히 벡터 vector라고 지칭)로 사용합니다. (그림 2). 바이러스는 사람에게 감염되어도 안전하도록 변형되고 세포의 핵으로 들어와 올바른 단백질을 발현시켜 단백질 기능을 복구하고 질병을 치료할 수 있도록 설계됩니다.
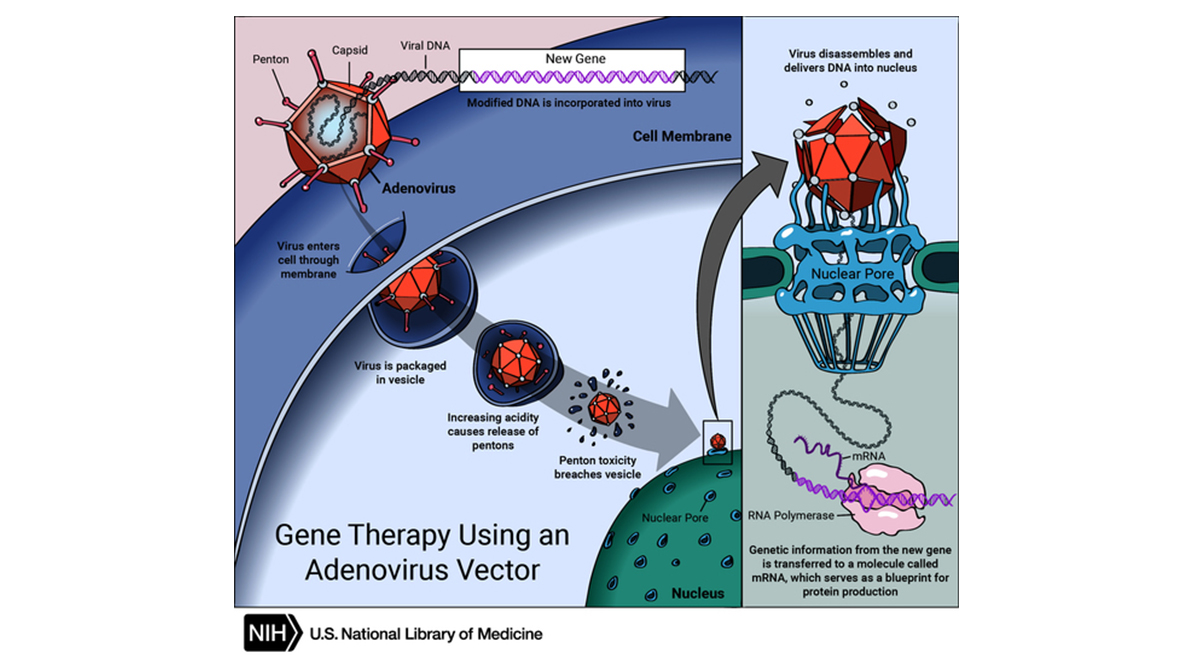
요즘 새롭게 각광받고 있는 유전자 치료제는 유전자 가위(CRISPR-Cas9)를 사용한 치료제입니다. 바이러스 벡터는 여러 부작용을 동반하지만 유전자 가위는 바이러스 벡터를 사용하지 않고 유전 물질을 세포 내에 전달할 수 있어 바이러스 치료제에서 자주 나타나는 면역반응을 유발할 가능성이 작고 여러 DNA를 표적할 수 있게 설계와 수정이 용이합니다. 우선 그림 3에서 보여지듯이 Cas9 단백질과 guide RNA(gRNA)를 세포 안에 전달하면 Cas9-gRNA 복합체가 표적 DNA를 인식하고 절단합니다. 절단된 유전자가 복구되면서 올바른 단백질을 생성할 수 있어 질병을 치료하게 됩니다.
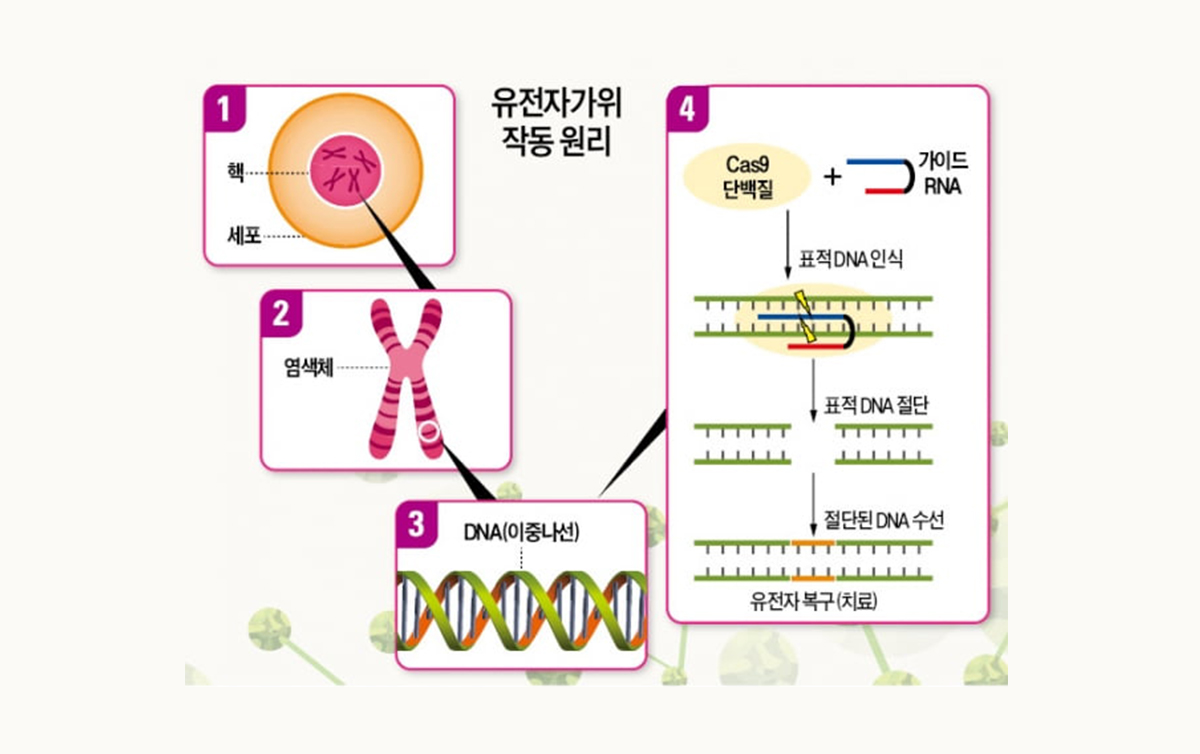
2. CAR-T 세포 치료제
유전자 치료와 더불어 합성생물학은 세포치료제에도 많이 응용되고 있습니다. CAR-T 세포 치료는 암 환자의 혈액에서 세포를 추출한 뒤 lentivirus를 이용하여 암세포 표면에 발현된 항체를 인지하는 키메릭 항원 수용체(Chimeric Antigen Receptor, CAR)를 발현하도록 하고, 이후 환자에게 재투여하는 과정으로 진행됩니다. (그림 4). 이미 여러 임상 실험에서 CAR-T 세포의 효능은 검증되어 2017년 최초의 CAR-T 치료제 KYMRIAH를 시작으로 현재 이미 5개 이상의 제품이 출시되고 개발되고 있습니다.
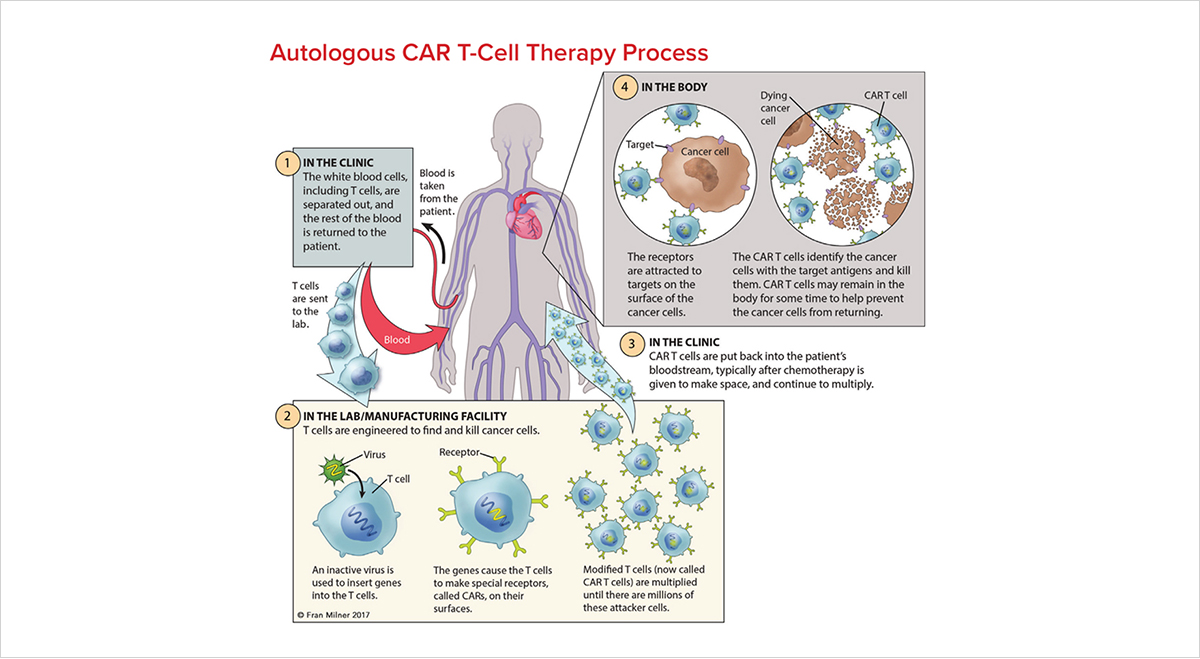
효과적인 치료제가 되기 위해서 많은 장벽이 남아 있지만, 합성생물학의 발전이 현재 세포 치료제의 한계를 극복하는 데 큰 도움이 될 것입니다. (그림 5). 우선 강력한 살상을 유도하는 CAR-T 세포 치료제는 종종 건강한 조직을 표적으로 삼거나 전신 면역 활성화를 유발하여 생명을 위협하는 사이토카인 방출 증후군(CRS)을 유발할 수 있으나 AND, OR, NOT과 같은 유전자 논리 회로를 세포에 도입한다면 좀 더 정확하고 안전한 CAR-T 세포 치료법을 개발할 수 있습니다. 이와 더불어 killswitch 및 activity switch를 사용한다면 CAR-T 세포의 제어력 또한 확장할 수 있습니다. 마지막으로 합성생물학을 통한 범용 수용체 개발을 통해 쉽게 항원 표적 전환이 가능하고 T 세포 활성 수준을 바꿀 수 있습니다. 이처럼 합성생물학은 최근 부각 되는 세포 및 유전자 치료제 개발에 활용이 기대되는 미래 지향적인 기술입니다.

[참고문헌]
[1] https://www.precedenceresearch.com/cell-and-gene-therapy-market
[2] https://medlineplus.gov/genetics/understanding/therapy/procedures/
[3] https://www.hankyung.com/it/article/2019073144141
[4] https://www.lls.org/treatment/types-treatment/immunotherapy/chimeric-antigen-receptor-car-t-cell-therapy
[5] https://doi.org/10.1016/j.cell.2021.01.017




