

서상우 교수
서울대학교 화학생물공학부
서상우 교수
서울대학교 화학생물공학부
합성생물학과 바이오파운드리 기술
1972년에 서로 다른 두 유전자를 자르고 이어 붙이는 유전자 재조합 기술이 개발된 이래, 유전공학 기술은 생명체의 유전자를 제거 또는 삽입함으로써 자연적으로는 존재하지 않던 성질을 가진 유용한 생명체를 만들어내는 데 이바지했다. 이 당시 제한 효소를 활용한 유전자 서열 합성은 해당 효소가 인지할 수 있는 서열이 있는 곳에만 유전자 재조합이 가능했기 때문에, 복잡한 유전자 회로를 구축하는 데에는 한계가 있었다. 그러나 기술의 발전으로 DNA 서열의 화학적 합성에 필요한 비용이 감소하고 서열 제한 없이 유전자 서열을 이어붙일 수 있는 DNA 조립 방법 등이 개발됨에 따라, 현대에는 여러 유전자 회로가 서로 복잡하게 얽혀 있는 서열을 원하는 대로 구성하는 것이 그리 어렵지 않게 되었다. 이러한 토대 위에서 합성생물학은 유전공학에서 더 나아가 유전자 발현에 관여하는 부품들을 체계화하고 전기 회로를 조립하듯 유전자 서열들을 조립함으로써, 유전자 재조합 및 형질전환을 통해 만들어진 생명체가 보다 체계적이고 효율적으로 기능할 수 있도록 하는 핵심적인 학문 분야로 자리매김하였다.
이처럼 합성생물학을 기반으로 최적의 유전자 회로를 구성하기 위해서는, 각 유전자 부품의 다양한 조합을 만들어내고 이들을 균주 내에서 실제로 기능을 테스트하는 일련의 과정이 필요하다. 생명체의 복잡성 및 유전자 부품 서열 간의 비독립성으로 인해 디자인된 유전자 회로가 정확히 원하는 대로 세포 내에서 기능하지 않을 수 있기 때문이다. 이러한 한계를 극복하기 위해서는 최대한 많은 경우의 수의 유전자 회로를 구성하고 데이터를 처리하는 것이 필요한데, 분자생물학 실험을 사람의 손에만 의지할 수 밖에 없었던 과거에는 대규모로 서열을 설계 및 합성하고 균주 내에서 테스트하는 것에 어려움이 있었다. 그러나 로봇 및 자동화 기술의 발전으로 인해 이제는 분자생물학 실험의 자동화가 상당히 진보했고, 유전자 서열을 합성 및 테스트할 수 있는 용량이 대폭 증가하게 되었으며, 이러한 로보틱스 기반 대규모의 생명공학 실험 자동화 시설 및 기술을 통칭해 ‘바이오파운드리(Biofoundry)’라 일컫는다 [1]. 본 글에서는 바이오파운드리 운영의 세계적 현황과 합성생물학 연구 흐름에서 바이오파운드리가 가지는 의의를 종합적으로 소개하고자 한다.
우리나라에서는 아직 개별 기업 및 연구소 단위로 바이오파운드리가 소규모로 운용되고 있으나, 해외의 경우 바이오파운드리 기반 대규모 자동화 실험이 다양한 생명공학 및 합성생물학 연구에 상당히 기여하고 있으며 이미 대사물질 생산 균주 및 mRNA 백신 개발 등 다양한 분야에 바이오파운드리 기술이 관여하고 있다. 그러나 각국 및 각지에 설립된 바이오파운드리 간에는 하드웨어 및 소프트웨어 인프라 공유에 한계가 있었으며, 협력 기구의 부재로 인해 바이오파운드리 운영을 통해 얻은 프로토콜 및 생물학적 데이터 공유에도 제한점이 있었다. 이러한 한계를 극복하고 바이오파운드리가 공공의 문제를 해결하는 합성생물학 연구에 더 크게 조력할 수 있도록, 2019년에 세계 바이오파운드리 연합체인 Global Biofoundry Alliance(GBA)가 결성되었다. GBA는 비경쟁적인 인프라 구성, 공개적인 표준 설립, 운영 프로토콜 및 바이오 부품의 정보 공유 등에 관한 협력을 약속했으며, 이를 바탕으로 아래의 5가지 목표를 추구하고 있다 [2].
1) 전 세계의 비상업적 목적의 바이오파운드리 개발, 홍보 및 지원
2) 바이오파운드리 간의 협력 및 소통 증대
3) 바이오파운드리 기술, 운영 전반에 관련된 문제에 대한 협동적 대응
4) 비상업적 바이오파운드리의 가시성, 영향 및 지속성의 향상
5) 세계적, 사회적으로 영향이 큰 문제들에 대한 협동 프로젝트 진행
이처럼 합성생물학을 기반으로 최적의 유전자 회로를 구성하기 위해서는, 각 유전자 부품의 다양한 조합을 만들어내고 이들을 균주 내에서 실제로 기능을 테스트하는 일련의 과정이 필요하다. 생명체의 복잡성 및 유전자 부품 서열 간의 비독립성으로 인해 디자인된 유전자 회로가 정확히 원하는 대로 세포 내에서 기능하지 않을 수 있기 때문이다. 이러한 한계를 극복하기 위해서는 최대한 많은 경우의 수의 유전자 회로를 구성하고 데이터를 처리하는 것이 필요한데, 분자생물학 실험을 사람의 손에만 의지할 수 밖에 없었던 과거에는 대규모로 서열을 설계 및 합성하고 균주 내에서 테스트하는 것에 어려움이 있었다. 그러나 로봇 및 자동화 기술의 발전으로 인해 이제는 분자생물학 실험의 자동화가 상당히 진보했고, 유전자 서열을 합성 및 테스트할 수 있는 용량이 대폭 증가하게 되었으며, 이러한 로보틱스 기반 대규모의 생명공학 실험 자동화 시설 및 기술을 통칭해 ‘바이오파운드리(Biofoundry)’라 일컫는다 [1]. 본 글에서는 바이오파운드리 운영의 세계적 현황과 합성생물학 연구 흐름에서 바이오파운드리가 가지는 의의를 종합적으로 소개하고자 한다.
우리나라에서는 아직 개별 기업 및 연구소 단위로 바이오파운드리가 소규모로 운용되고 있으나, 해외의 경우 바이오파운드리 기반 대규모 자동화 실험이 다양한 생명공학 및 합성생물학 연구에 상당히 기여하고 있으며 이미 대사물질 생산 균주 및 mRNA 백신 개발 등 다양한 분야에 바이오파운드리 기술이 관여하고 있다. 그러나 각국 및 각지에 설립된 바이오파운드리 간에는 하드웨어 및 소프트웨어 인프라 공유에 한계가 있었으며, 협력 기구의 부재로 인해 바이오파운드리 운영을 통해 얻은 프로토콜 및 생물학적 데이터 공유에도 제한점이 있었다. 이러한 한계를 극복하고 바이오파운드리가 공공의 문제를 해결하는 합성생물학 연구에 더 크게 조력할 수 있도록, 2019년에 세계 바이오파운드리 연합체인 Global Biofoundry Alliance(GBA)가 결성되었다. GBA는 비경쟁적인 인프라 구성, 공개적인 표준 설립, 운영 프로토콜 및 바이오 부품의 정보 공유 등에 관한 협력을 약속했으며, 이를 바탕으로 아래의 5가지 목표를 추구하고 있다 [2].
1) 전 세계의 비상업적 목적의 바이오파운드리 개발, 홍보 및 지원
2) 바이오파운드리 간의 협력 및 소통 증대
3) 바이오파운드리 기술, 운영 전반에 관련된 문제에 대한 협동적 대응
4) 비상업적 바이오파운드리의 가시성, 영향 및 지속성의 향상
5) 세계적, 사회적으로 영향이 큰 문제들에 대한 협동 프로젝트 진행
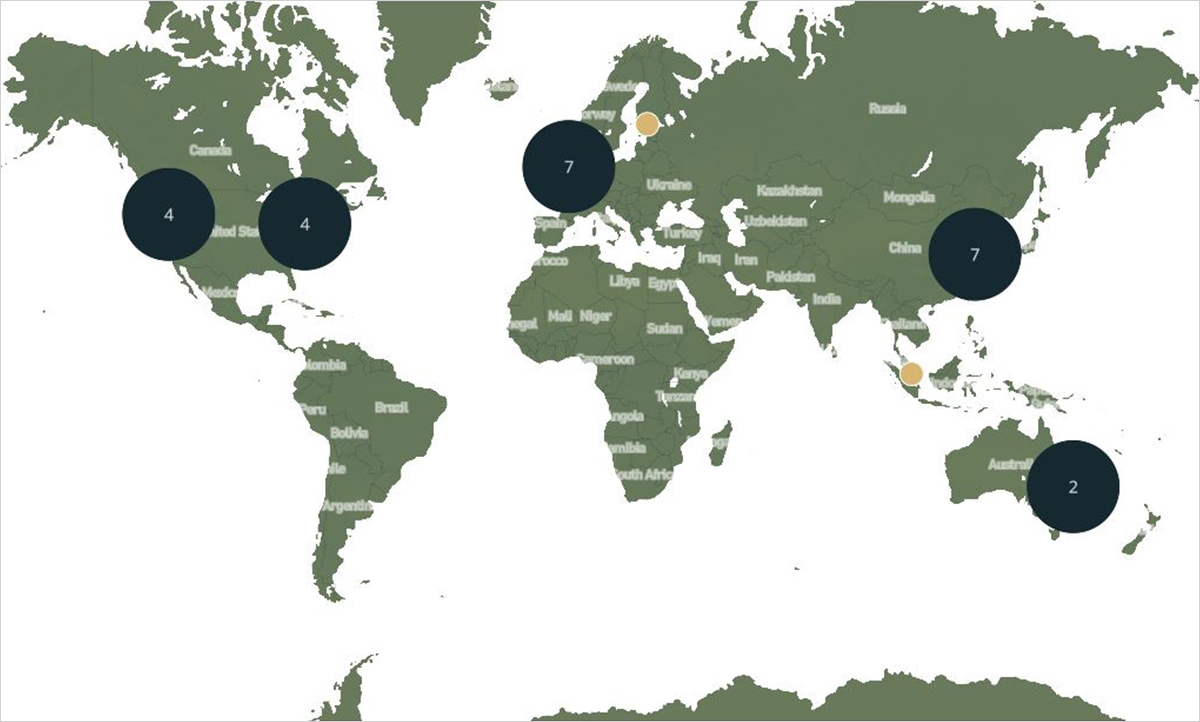
이처럼 바이오파운드리의 세계적 협력체가 구축된 이유는 바이오파운드리를 설립하고 운영하기 위해서는 로봇 및 AI 등 생명공학 바깥의 다양한 공학 분야의 기술이 필요하고, 합성생물학의 순환적 연구 흐름인 Design-Build-Test-Learn (DBTL) cycle의 고도화 및 자동화에 이들 기술이 효율적으로 활용될 수 있는지에 관한 평가 및 피드백을 공유하기 위함이다. DBTL cycle은 합성생물학 분야에서 특정한 목적을 효율적으로 수행할 수 있는 DNA 서열 및 균주를 구축하는 설계 규칙을 정립하기 위해 반복적으로 수행되는 일련의 연구 과정을 일컫는다. 각 단계를 하나씩 살펴보면, Design 단계에서는 물질대사 경로, 유전자 회로 등을 구성하기 위해 각각을 구성하는 유전자 발현 부품, 단백질, 효소 등을 선택하여 DNA 서열을 디자인한다. Build 단계에서는 선택된 DNA 정보들을 다양한 합성, 조립 방법을 사용하여 실물화한다. Test 단계에서는 이렇게 구성된 유전자 서열이 살아있는 세포나 무세포(cell-free) 시스템 내에서 어느 정도로 기능하는지에 대해 정량적으로 측정한다. Learn 단계에서는 앞선 단계에서 수집한 정보를 바탕으로 유전자 서열의 디자인과 그에 따른 결과에 대한 상관관계를 도출함으로써, 차후 이어질 DBTL cycle의 디자인 단계에서 활용 가능한 정보들을 제공한다.
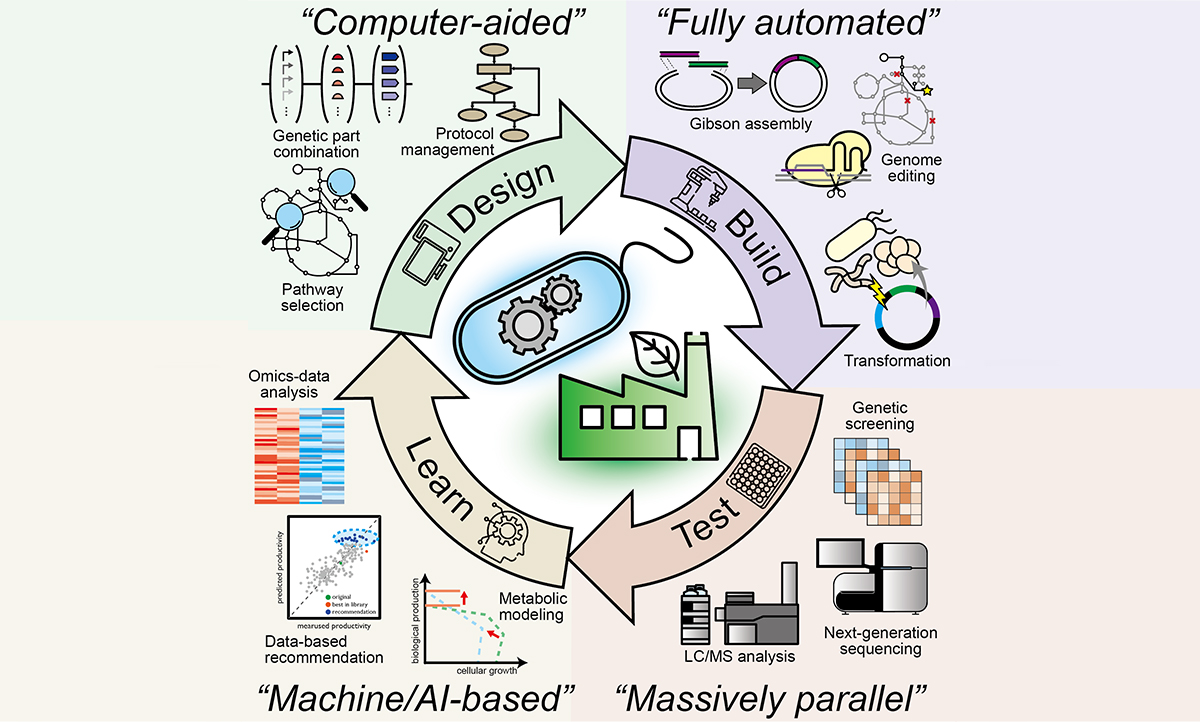
그림 2 . 바이오파운드리를 활용한 합성생물학의 DBTL cycle 가속화 및 고도화
기존의 합성생물학 연구 흐름에서도 이러한 DBTL cycle은 잘 유지되어 왔으나, 바이오파운드리는 이러한 토대 위에 실험 자동화 기술 및 디자인 소프트웨어, 머신 러닝 등을 도입함으로써 DBTL cycle의 각 단계를 가속하고 고도화할 수 있다. 바이오파운드리 기반의 합성생물학 실험에서 Design 단계는 주로 컴퓨터 기반의 유전자 부품 및 회로 디자인으로 진행된다. 박테리아에서는 유전자의 프로모터와 리보솜 결합 서열이 어떠한지에 따라 각각 유전자의 전사 및 번역 세기가 결정되는데, 이러한 정보를 기반으로 물질 생산 경로를 구성하는 개별 유전자의 발현 세기를 다양한 조합으로 구성할 수 있다. Design 단계에서는 또한 균주의 유전체 자체를 편집함으로써 최적의 대사경로를 구성하는 것도 포함한다. 유전체 정보로부터 모델링한 대사 경로를 바탕으로 타겟 물질의 최적 생산을 위해 과발현 및 제거해야 하는 유전자들을 선정하고 이를 실험자에게 제안하도록 할 수 있다. 또한, 원하는 단백질 혹은 최적의 활성을 갖는 효소를 설계하는 것도 포함한다. 최근에는 DNA 어셈블리 실험 디자인부터 재고 관리, 프로토콜 실행 및 데이터 수집까지의 전 과정을 디자인할 수 있는 Aquarium이라는 프로그램이 개발되어 현재 Washington 대학의 바이오파운드리에서 사용되고 있다 [4]. 이처럼 바이오파운드리 기반의 합성생물학 실험 디자인은 컴퓨터의 도움으로 표준화된 서열 디자인 및 실험 프로토콜을 수립하고 수학적 모델링을 기반으로 균주의 유전체를 편집함으로써 보다 효율적인 합성생물학 실험의 기초를 놓을 수 있다.
Build 단계에서는 앞선 단계에서 디자인한 실험 계획을 바탕으로 실제로 유전자 서열을 합성하거나 균주의 유전체를 편집하게 된다. 이 과정은 보통 DNA 조각을 이어붙이는 어셈블리 실험이나 만들어진 플라스미드 DNA를 균주에 형질전환하는 실험 등으로 이루어지는데, 모두 액상에서 진행되기 때문에 마이크로파이펫을 활용한 실험자의 노동력에 의존해왔다. 따라서 많은 경우의 수의 유전자 서열을 테스트하기 위해 준비하려면 그만큼의 시간과 비용, 노동력이 필요했기에 실험을 대규모로 진행하는 것에 상당한 어려움이 있었다. 그러나 바이오파운드리는 이 과정에서 소량의 액체를 정밀하게 계량 및 혼합할 수 있는 로봇 기술을 활용함으로써 유전자 서열 합성에 필요한 노동력을 획기적으로 줄이고 한꺼번에 훨씬 많은 수의 서열을 병렬적으로 보다 저렴하게 합성할 수 있다. 액체를 다루는 일을 자동화할 수 있는 로봇 기술이 개발된 것이야말로 바이오파운드리의 근간이라고 할 수 있으며, 현재도 바이오파운드리의 발전에 발맞추어 PerkinElmer, Hamilton, Tecan, Beckman, Eppendorf 등의 주요 생명공학 기업들이 이 기술의 발전을 선도하고 있다 [5].
바이오파운드리의 Test 단계는 컴퓨터 기반으로 구축한 서열 및 균주가 실제로 배양 환경에서 나타내는 표현형을 정성 및 정량적으로 측정하여 데이터를 얻는 단계이며, Build 단계의 연장선에서 마찬가지로 자동화된 액체 핸들링 로봇이 활용될 수 있다. 로봇을 활용하여 각각의 균주 콜로니를 자동으로 액체 배지에 접종하고, 실험 디자인 및 목적에 따라 형광 단백질 발현은 FACS나 마이크로플레이트 리더 기계를 활용하여 측정할 수 있다. 실제 물질 생산은 HPLC나 LC/GC-MS와 같은 분석 기기를 활용하여 측정하거나 무세포 시스템을 통해 더욱 빠르게 활성 측정이 가능한 경우도 있다.
마지막 Learn 단계에서는 Test 단계까지의 실험 데이터를 바탕으로 차후 이어질 DBTL cycle에 활용될 수 있는 유전자 및 유전체 디자인 기준을 수립하거나 새로이 검증할 만한 과학적 가설을 수립하게 된다. 바이오파운드리를 통해 얻은 방대한 양의 데이터가 유의미하게 활용되려면 Design 단계에서 입력한 DNA 서열 정보의 특징들과 Test 단계를 거쳐 출력되는 데이터 사이의 연관성을 파악해야 하며, 이를 위해서는 기계학습 및 AI 분야의 접목이 필요하다. 최근에 개발된 ART(Automated Recommendation Tool)라는 툴은 기계학습의 bayesian ensemble approach를 합성생물학 실험 데이터에 적용하여 예측 모델을 만들고 이를 기반으로 다음 DBTL cycle에 활용할 수 있는 새로운 디자인을 제시함으로써, 미생물 발효를 통해 생산할 수 있는 바이오 연료인 Limonene의 생산성을 향상시킬 수 있음을 보여주었다 [6]. 이처럼 최신의 소프트웨어 러닝 툴을 활용하여 방대하고 다층적인 실험 데이터로부터 생물학적 예측 모델을 도출하는 일은 현재진행형이며, 이 분야에서의 발전은 바이오파운드리 기반의 DBTL cycle이 연속적으로 이어질 수 있게 하는 데 있어 핵심이 될 것이다.
바이오파운드리는 고도화된 하드웨어 및 소프트웨어 기술이 생명의 복잡성 및 노동력의 한계라는 문제를 해소하고, 합성생물학을 포함한 생명공학의 연구가 보다 예측 가능한 방향으로 나아갈 수 있음을 보여주는 대표적인 기술이라고 할 수 있겠다. 앞으로 우리나라뿐만 아니라 전세계적으로 로봇 및 AI 기술의 발전과 이를 생명공학에 접목하는 시도가 더욱 활성화 될 것으로 예상되며, 바이오파운드리를 바탕으로 합성생물학 분야를 이끄는 다양한 연구가 활발하게 일어나길 기대해 본다.

기존의 합성생물학 연구 흐름에서도 이러한 DBTL cycle은 잘 유지되어 왔으나, 바이오파운드리는 이러한 토대 위에 실험 자동화 기술 및 디자인 소프트웨어, 머신 러닝 등을 도입함으로써 DBTL cycle의 각 단계를 가속하고 고도화할 수 있다. 바이오파운드리 기반의 합성생물학 실험에서 Design 단계는 주로 컴퓨터 기반의 유전자 부품 및 회로 디자인으로 진행된다. 박테리아에서는 유전자의 프로모터와 리보솜 결합 서열이 어떠한지에 따라 각각 유전자의 전사 및 번역 세기가 결정되는데, 이러한 정보를 기반으로 물질 생산 경로를 구성하는 개별 유전자의 발현 세기를 다양한 조합으로 구성할 수 있다. Design 단계에서는 또한 균주의 유전체 자체를 편집함으로써 최적의 대사경로를 구성하는 것도 포함한다. 유전체 정보로부터 모델링한 대사 경로를 바탕으로 타겟 물질의 최적 생산을 위해 과발현 및 제거해야 하는 유전자들을 선정하고 이를 실험자에게 제안하도록 할 수 있다. 또한, 원하는 단백질 혹은 최적의 활성을 갖는 효소를 설계하는 것도 포함한다. 최근에는 DNA 어셈블리 실험 디자인부터 재고 관리, 프로토콜 실행 및 데이터 수집까지의 전 과정을 디자인할 수 있는 Aquarium이라는 프로그램이 개발되어 현재 Washington 대학의 바이오파운드리에서 사용되고 있다 [4]. 이처럼 바이오파운드리 기반의 합성생물학 실험 디자인은 컴퓨터의 도움으로 표준화된 서열 디자인 및 실험 프로토콜을 수립하고 수학적 모델링을 기반으로 균주의 유전체를 편집함으로써 보다 효율적인 합성생물학 실험의 기초를 놓을 수 있다.
Build 단계에서는 앞선 단계에서 디자인한 실험 계획을 바탕으로 실제로 유전자 서열을 합성하거나 균주의 유전체를 편집하게 된다. 이 과정은 보통 DNA 조각을 이어붙이는 어셈블리 실험이나 만들어진 플라스미드 DNA를 균주에 형질전환하는 실험 등으로 이루어지는데, 모두 액상에서 진행되기 때문에 마이크로파이펫을 활용한 실험자의 노동력에 의존해왔다. 따라서 많은 경우의 수의 유전자 서열을 테스트하기 위해 준비하려면 그만큼의 시간과 비용, 노동력이 필요했기에 실험을 대규모로 진행하는 것에 상당한 어려움이 있었다. 그러나 바이오파운드리는 이 과정에서 소량의 액체를 정밀하게 계량 및 혼합할 수 있는 로봇 기술을 활용함으로써 유전자 서열 합성에 필요한 노동력을 획기적으로 줄이고 한꺼번에 훨씬 많은 수의 서열을 병렬적으로 보다 저렴하게 합성할 수 있다. 액체를 다루는 일을 자동화할 수 있는 로봇 기술이 개발된 것이야말로 바이오파운드리의 근간이라고 할 수 있으며, 현재도 바이오파운드리의 발전에 발맞추어 PerkinElmer, Hamilton, Tecan, Beckman, Eppendorf 등의 주요 생명공학 기업들이 이 기술의 발전을 선도하고 있다 [5].
바이오파운드리의 Test 단계는 컴퓨터 기반으로 구축한 서열 및 균주가 실제로 배양 환경에서 나타내는 표현형을 정성 및 정량적으로 측정하여 데이터를 얻는 단계이며, Build 단계의 연장선에서 마찬가지로 자동화된 액체 핸들링 로봇이 활용될 수 있다. 로봇을 활용하여 각각의 균주 콜로니를 자동으로 액체 배지에 접종하고, 실험 디자인 및 목적에 따라 형광 단백질 발현은 FACS나 마이크로플레이트 리더 기계를 활용하여 측정할 수 있다. 실제 물질 생산은 HPLC나 LC/GC-MS와 같은 분석 기기를 활용하여 측정하거나 무세포 시스템을 통해 더욱 빠르게 활성 측정이 가능한 경우도 있다.
마지막 Learn 단계에서는 Test 단계까지의 실험 데이터를 바탕으로 차후 이어질 DBTL cycle에 활용될 수 있는 유전자 및 유전체 디자인 기준을 수립하거나 새로이 검증할 만한 과학적 가설을 수립하게 된다. 바이오파운드리를 통해 얻은 방대한 양의 데이터가 유의미하게 활용되려면 Design 단계에서 입력한 DNA 서열 정보의 특징들과 Test 단계를 거쳐 출력되는 데이터 사이의 연관성을 파악해야 하며, 이를 위해서는 기계학습 및 AI 분야의 접목이 필요하다. 최근에 개발된 ART(Automated Recommendation Tool)라는 툴은 기계학습의 bayesian ensemble approach를 합성생물학 실험 데이터에 적용하여 예측 모델을 만들고 이를 기반으로 다음 DBTL cycle에 활용할 수 있는 새로운 디자인을 제시함으로써, 미생물 발효를 통해 생산할 수 있는 바이오 연료인 Limonene의 생산성을 향상시킬 수 있음을 보여주었다 [6]. 이처럼 최신의 소프트웨어 러닝 툴을 활용하여 방대하고 다층적인 실험 데이터로부터 생물학적 예측 모델을 도출하는 일은 현재진행형이며, 이 분야에서의 발전은 바이오파운드리 기반의 DBTL cycle이 연속적으로 이어질 수 있게 하는 데 있어 핵심이 될 것이다.
바이오파운드리는 고도화된 하드웨어 및 소프트웨어 기술이 생명의 복잡성 및 노동력의 한계라는 문제를 해소하고, 합성생물학을 포함한 생명공학의 연구가 보다 예측 가능한 방향으로 나아갈 수 있음을 보여주는 대표적인 기술이라고 할 수 있겠다. 앞으로 우리나라뿐만 아니라 전세계적으로 로봇 및 AI 기술의 발전과 이를 생명공학에 접목하는 시도가 더욱 활성화 될 것으로 예상되며, 바이오파운드리를 바탕으로 합성생물학 분야를 이끄는 다양한 연구가 활발하게 일어나길 기대해 본다.
[참고문헌]
[1] These 'biofoundries' use DNA to make natural products we need. https://www.weforum.org/agenda/2019/10/biofoundries-the-new-factories-for-genetic-products/
[2] Hillson, N. et al. Building a global alliance of biofoundries. Nat. Commun. 10, 1038–1041 (2019).
[3] NUS Synthetic Biology for Clinical and Technological Innovation (SynCTI). https://syncti.org/bio-foundry/
[4] Vrana, J. et al. Aquarium: open-source laboratory software for design, execution and data management. Synth. Biol. 6, 1–9 (2021).
[5] Tellechea-Luzardo, J., Otero-Muras, I., Goñi-Moreno, A. & Carbonell, P. Fast biofoundries: coping with the challenges of biomanufacturing. Trends Biotechnol. 40, 831–842 (2022).
[6] Radivojević, T., Costello, Z., Workman, K. & Garcia Martin, H. A machine learning Automated Recommendation Tool for synthetic biology. Nat. Commun. 11, 1–14 (2020).




