

전호정
KIST 생체재료연구센터 책임연구원
전호정
KIST 생체재료연구센터 책임연구원
표면개질을 통한 메카노포레틱 세포제어 기술
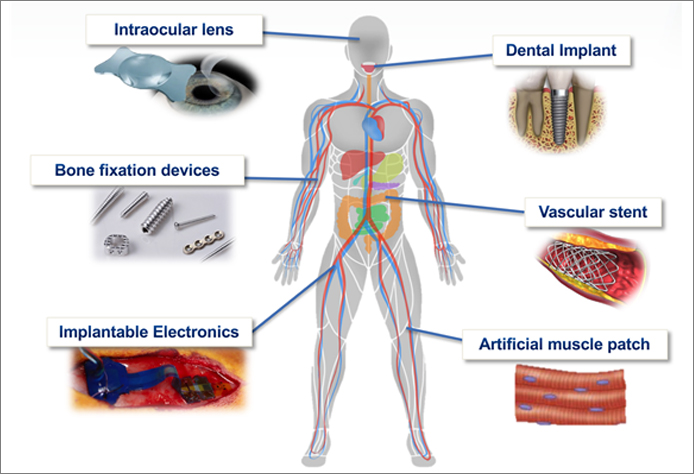
생체재료는 ‘의료용 장치, 인공장기에 사용하는 재료 중 인체의 정상적인 조직과 접촉하여 사용하는 재료의 총칭’을 말한다. 인체에 삽입하는 의료장치나 인공장기는 손상된 장기나 조직을 대신하기 위해서 사용한다. 따라서 원래 조직이 가지고 있던 기능과 특성을 재현할 수 있어야 하며 주변의 정상조직에 나쁜 영향을 주지 않아야 한다. 인체에 이식하는 의료기기는 관절대체품(Joint replacements), 골고정판(Bone plates), 골고정나사(Bone screw), 골시멘트(Bone cement), 인공인대 등의 정형외과용 소재와 치과용 임플란트와 같이 뼈와 연관된 소재들이 가장 많이 활용되고 있으며, 인공심장밸브, 혈관스텐트, 인공혈관 등의 심혈관질환 관련 소재, 달팽이관 대체품, 인공수정체, 콘택트렌즈, 인공가슴, 그리고 그 외에 수술 시에 사용하는 봉합사, 클립, 스테플러 등의 소재로 많이 쓰이고 있다. 또한, 인공와우, 인공시각, 페이스메이커 등 이식용 전자기기도 손상된 인체조직을 대신하기 위해 사용되고 있다. 최근에는 웨어러블 디바이스의 발전에 이어, 인체이식용 센서나 전자약 등으로 활용하기 위한 인체삽입용 마이크로 전자디바이스 연구 또한 활발히 이루어지고 있다.
생체재료의 개발 초기에는 질병 또는 손상된 조직을 치유하기 위한 목적으로 연구가 이루어졌다. 환자의 생체 이식 부위에 적합한 물리적 특성을 가지고 조직을 대신할 수 있는 재료를 개발하는 것이 주된 이슈였다. 과학기술이 발전하면서 생체활성 기능을 하거나 생분해 특성을 가지는 생체재료가 개발되었고, 2000년대 이후 분자 단위에서 세포의 부착 및 거동을 조절하고 조직 재생을 도와 상처 치유 기능을 개선하는 기능을 가진 생체재료에 대한 연구가 시작되었다.
인공적인 소재가 생체 내에 삽입되면 조직과 생체재료간의 상호 작용이 일어난다. 이 때, 세포가 재료 표면에 접촉하여 환경의 변화가 일어나며 생물학적 반응을 결정하게 된다. 재료 표면의 화학적 특성과 물리적인 나노구조에 의해 세포 및 조직에 영향을 주게 된다. 특히, 세포의 초점접착역(focal adhesion)이 50~200 nm 정도의 크기이기 때문에 나노구조 패턴을 이용하여 세포를 제어하는 방법에 대한 연구가 최근 활성화 되는 추세이다. 세포를 둘러싸고 있는 세포외기질 단백질(extracellular matrix protein)은 나노구조를 띠고 있다. 예를 들어, 세포외기질의 주요 단백질 중 하나인 콜라겐은 직경 약 1.5 nm, 길이 약 300 nm의 크기를 가지는 분자이다. 이 콜라겐이 여럿 모여 직경 약 300 nm에 수십 마이크로미터 길이의 원섬유를 이룬다. 또한 많은 조직들의 기저막(basement membrane)도 나노 크기의 패턴 형상을 띠고 있는 것으로 알려져 있다. 세포는 이러한 나노구조에 부착하여 크기 혹은 형상을 인지하고 반응하는 것으로 알려져 있다. 치료용, 생체 대체용 및 조직공학용 생체재료는 세포와 가장 먼저 접하게 되어 세포의 부착, 증식, 분화, 사멸 등 전반적인 세포 활동에 중요한 역할을 한다. 따라서 세포와 재료 표면의 나노구조와의 연관성을 밝혀내면 생체재료의 생체 적합성을 높이고, 생체 기능성을 발휘하는 구조를 알아낼 수 있다.
재료의 표면에 나노구조 패턴을 가공하여 여러 가지 특성을 가진 표면을 제작할 수 있다는 논문 발표가 이어지고 있으며, 주목받고 있는 표면 기능은 다음과 같다.
• 세포가 붙지 않는 표면 혹은 세포가 잘 붙는 표면
• 성체줄기세포의 분화조절인자 없이 골계세포로의 분화를 유도하는 표면
• 성체줄기세포의 세포원성(stemness)를 유지하며 세포증식을 유도하는 표면 등
따라서 세포의 기능을 조절하고자 하는 과학자들 사이에서 나노구조 패터닝을 이용하는 방법이 최근 각광을 받고 있다. 기존에는 약물을 탑재해 재료의 생체 적합성을 조절했다. 이와 달리 나노구조를 이용하게 되면 불필요한 공정을 줄일 수 있고, 새로운 외부 물질에 의한 생체의 부작용 등을 최소화할 수 있다. 나노공정을 통하여 제작할 수 있는 나노구조 표면은 형상에 따라 나노격자(nanograting), 나노기둥(nanopost), 나노기공(nanopit), 임의형상(random structure) 등으로 구분할 수 있다. 나노 구조의 형상 및 크기에 따라 세포부착이 좋아지거나 반대로 안좋아지게 할 수 있으며, 이 부착 특성은 세포의 증식, 사멸 및 분화에 영향을 줄 수가 있다.
생체재료의 개발 초기에는 질병 또는 손상된 조직을 치유하기 위한 목적으로 연구가 이루어졌다. 환자의 생체 이식 부위에 적합한 물리적 특성을 가지고 조직을 대신할 수 있는 재료를 개발하는 것이 주된 이슈였다. 과학기술이 발전하면서 생체활성 기능을 하거나 생분해 특성을 가지는 생체재료가 개발되었고, 2000년대 이후 분자 단위에서 세포의 부착 및 거동을 조절하고 조직 재생을 도와 상처 치유 기능을 개선하는 기능을 가진 생체재료에 대한 연구가 시작되었다.
인공적인 소재가 생체 내에 삽입되면 조직과 생체재료간의 상호 작용이 일어난다. 이 때, 세포가 재료 표면에 접촉하여 환경의 변화가 일어나며 생물학적 반응을 결정하게 된다. 재료 표면의 화학적 특성과 물리적인 나노구조에 의해 세포 및 조직에 영향을 주게 된다. 특히, 세포의 초점접착역(focal adhesion)이 50~200 nm 정도의 크기이기 때문에 나노구조 패턴을 이용하여 세포를 제어하는 방법에 대한 연구가 최근 활성화 되는 추세이다. 세포를 둘러싸고 있는 세포외기질 단백질(extracellular matrix protein)은 나노구조를 띠고 있다. 예를 들어, 세포외기질의 주요 단백질 중 하나인 콜라겐은 직경 약 1.5 nm, 길이 약 300 nm의 크기를 가지는 분자이다. 이 콜라겐이 여럿 모여 직경 약 300 nm에 수십 마이크로미터 길이의 원섬유를 이룬다. 또한 많은 조직들의 기저막(basement membrane)도 나노 크기의 패턴 형상을 띠고 있는 것으로 알려져 있다. 세포는 이러한 나노구조에 부착하여 크기 혹은 형상을 인지하고 반응하는 것으로 알려져 있다. 치료용, 생체 대체용 및 조직공학용 생체재료는 세포와 가장 먼저 접하게 되어 세포의 부착, 증식, 분화, 사멸 등 전반적인 세포 활동에 중요한 역할을 한다. 따라서 세포와 재료 표면의 나노구조와의 연관성을 밝혀내면 생체재료의 생체 적합성을 높이고, 생체 기능성을 발휘하는 구조를 알아낼 수 있다.
재료의 표면에 나노구조 패턴을 가공하여 여러 가지 특성을 가진 표면을 제작할 수 있다는 논문 발표가 이어지고 있으며, 주목받고 있는 표면 기능은 다음과 같다.
• 세포가 붙지 않는 표면 혹은 세포가 잘 붙는 표면
• 성체줄기세포의 분화조절인자 없이 골계세포로의 분화를 유도하는 표면
• 성체줄기세포의 세포원성(stemness)를 유지하며 세포증식을 유도하는 표면 등
따라서 세포의 기능을 조절하고자 하는 과학자들 사이에서 나노구조 패터닝을 이용하는 방법이 최근 각광을 받고 있다. 기존에는 약물을 탑재해 재료의 생체 적합성을 조절했다. 이와 달리 나노구조를 이용하게 되면 불필요한 공정을 줄일 수 있고, 새로운 외부 물질에 의한 생체의 부작용 등을 최소화할 수 있다. 나노공정을 통하여 제작할 수 있는 나노구조 표면은 형상에 따라 나노격자(nanograting), 나노기둥(nanopost), 나노기공(nanopit), 임의형상(random structure) 등으로 구분할 수 있다. 나노 구조의 형상 및 크기에 따라 세포부착이 좋아지거나 반대로 안좋아지게 할 수 있으며, 이 부착 특성은 세포의 증식, 사멸 및 분화에 영향을 줄 수가 있다.

글라스코 대학의 Dalby교수 그룹에서 나노기공 패턴을 이용하여 줄기세포의 분화능을 조절할 수 있다는 연구 결과를 2007년도와 2011년도에 Nature Materials에 발표하면서 나노패턴에 관한 연구는 더욱 많은 관심을 받게 되었다. 세포는 수십나노미터의 거리도 인지하며, 규칙적으로 배열된 나노패턴 위에서는 줄기세포가 분화능을 유지한 채 증식하며, 불규칙 패턴 상에서는 뼈세포로 분화하였다. 지금까지의 연구가 반도체 공정을 이용한 연구였다면, 2015년에 펨토초레이저를 이용한 나노표면 패터닝으로 세포의 부착 및 이동방향을 조절하는 연구결과가 Nature Materials지에 발표되며 나노표면개질 기술을 의료기기에 적용하는데 한발짝 더 다가섰다. 하지만, 나노구조를 이용한 표면개질 연구발표는 실험실에서의 In-vitro 실험 결과가 대부분으로 동물이나 인체 조직의 수복 및 치료용으로 활용이 가능할지에 대한 연구 보고는 아직 부족한 실정이다.
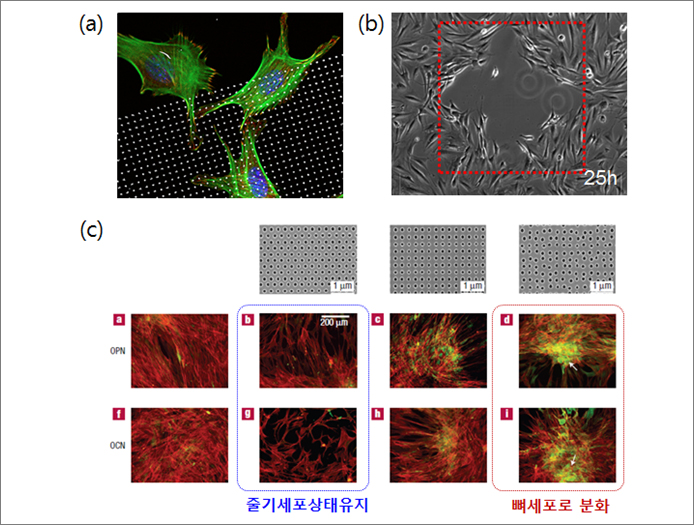
(c) 나노패턴 배열에 따른 줄기세포 분화조절[3]
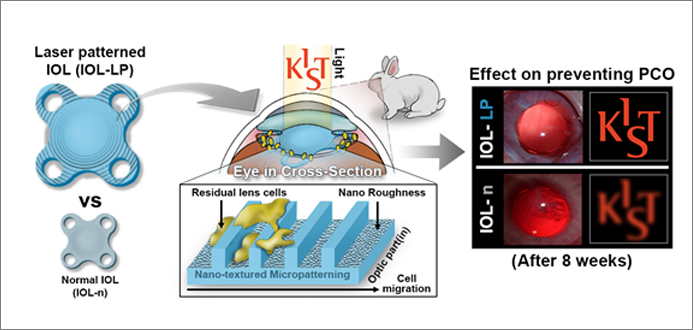
최근에 나노패턴이 실제 동물모델에서도 효과적으로 세포의 이동과 증식을 조절할 수 있다는 논문이 발표되었다. 펨토초레이저를 이용한 정밀가공을 이용하여 인공수정체에 나노패터닝을 적용하여 후발백내장을 억제할 수 있었다. 후발백내장은 백내장 수술 이후에 수정체 상피세포가 인공수정체 뒤쪽으로 이동하고 증식하여서 생기는 일종의 부작용으로 시야가 다시 흐릿해지는 증상이다. 이때 나노패턴을 이용해서 세포의 이동과 증식을 억제함으로써 후발백내장이 발생하는 정도를 약 50% 줄일 수 있었다.
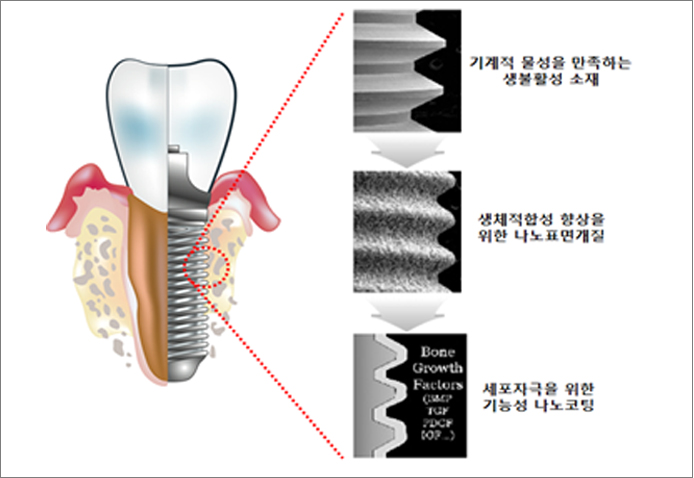
실제 의료산업 현장에서 생체 적합성 나노구조를 이용하여 표면개질을 적용한 분야는 치아, 골질환 치료용 임플란트가 대표적이다. 임플란트 표면개질을 위하여 모재의 표면조도를 개질하는 방법과 생체적합성 소재를 코팅하는 기술들은 이미 사용되고 있다. 주로 표면에 거칠기나 다공성 박막을 입히는 물리적 처리 방법, 생체 친화성을 높이고 골전도성을 향상시키기 위한 생화학적 처리 방법이 개발되었다. 이러한 기술들을 적용한 치과용 티타늄 임플란트들은 제품화되어 시판되고 있으며, 성공적이라고 평가받고 있다. 그러나 최근에 나노구조와 세포와의 연관성 등이 밝혀지면서 나노기술을 이용한 새로운 제품의 개발 가능성은 여전히 무궁무진하다. 골융합을 촉진시키고, 표피세포의 접근을 막으며, 환자 개개인의 질병에 맞추어 설계된 지능형 기능성 임플란트에 대한 연구로 확장할 수 있다. 지능형 임플란트를 개발하기 위해서는 표면 거칠기를 조절하는 수준의 표면개질의 수준을 넘어서야 한다. 현재까지 개발된 초정밀 미세가공기술들을 임플란트 표면에 적용하여 표면조도와 함께 표면형상도 나노스케일에서 조절하기위한 연구들이 진행 되어야 할 것이다. 아쉽지만, 초정밀 미세가공 기술들이 주로 반도체 공정에 최적화되어있기 때문에 생체재료에 적용할 수 있는 공정장비는 많지가 않다. 동시에 나노구조와 세포와의 연관성에 관한 연구도 중요하다. 많은 좋은 연구 결과들이 나오고 있지만, 새로운 나노구조나 크기에 따른 세포의 새로운 기능을 찾는 수준에 그치고 있다. 세포가 나노구조를 감지하고 새포내 신호를 전달하여 새로운 기능을 하는지에 대한 정확한 메커니즘을 밝히기 위한 연구도 한참 진행중이다.
나노-바이오 융합기술은 현재 정형화되지 않은 상태로 산업화에 이르지 못해 경제적인 효과가 미미한 수준이다. 그러나 최근 학계에서는 새로운 패러다임을 제시하고 있으며 나노-바이오 융합기술의 무한한 가능성은 앞으로 새로운 개념의 제품, 새로운 산업의 원천기술을 확보하는 것으로 이어져 우리나라의 고부가가치 산업을 이끌어갈 수 있는 중요한 기술로 자리매김할 것이다.
[참고자료]
• Bettinger C.J. et al., Engineering substrate topography at the micro- and nanoscale to control cell function, Angew. Chem. Int. Ed. 2009, 48(30):5406-5415
• Jeon H. et al., Directing cell migration and organization via nanocrater-patterned cell-repellent interfaces, Nature Materials, 2015, 14:918-923.
• McMurray R. J. et al., Nanoscale surface for the long-term maintenance of mesenchymal stem cell phenotype and multipotency, Nature Materials, 2011, 10:637-644.
• Seo Y., Kim S., Lee H.S. et al., Femtosecond laser induced nano-textured micropatterning to regulate cell functions on implanted biomaterials, Acta Biomaterialia, 2020, 15(116):138-148.



